两种药应用时有何区别?
痛风是血尿酸过高而沉积在关节、组织中而造成多种损害的一组疾病,严重者可并发心血管疾病、肾功能衰竭,最终可能危及生命。
其急性期发作的特征是关节发热红肿、疼痛,此时,选择正确的药物控制病情、缓解患者的疼痛感是至关重要的。
《痛风基层合理用药指南(2021)》中提到,在痛风急性发作期,秋水仙碱或非甾体抗炎药(NSAIDs)是急性关节炎发作的一线治疗药物。那么,这两种药有何区别呢?笔者整理如下,供参考。
急性期,首选谁?
2016年《中国痛风诊疗指南》中提到,在痛风急性发作期时推荐首选NSAIDs缓解症状,对NSAIDs有禁忌的患者,建议单独使用低剂量秋水仙碱。
而最近的《痛风基层合理用药指南(2021)》及《中国高尿酸血症与痛风诊疗指南(2019)》中均未提及二者中首选谁,而是将二者都作为抗炎镇痛的一线药物。
其中,NASIDs选用应结合患者个体情况,但在预防患者降尿酸初期的痛风发作时,则推荐首选小剂量(0.5~1mg)秋水仙碱。对不耐受秋水仙碱的患者,国内外指南均推荐使用小剂量NSAIDs作为二线药物(不超过常规剂量的50%)。
用药时主要有哪些区别?
01
秋水仙碱
作用机制:
能够与粒细胞微管蛋白结合,从而阻碍粒细胞的具体活动,抑制住粒细胞浸润。
临床应用:
秋水仙碱是第一个用于痛风抗炎镇痛治疗的药物,目前仍是痛风急性发作的一线用药,对其他原因引起的关节疼痛无效。它不影响尿酸盐的生成、溶解及排泄,因而也无降血尿酸作用。
其最宜在痛风急性发作12h内开始用药,超过36h疗效明显下降。通常,秋水仙碱在口服后12~24h起效,90%的患者在服药24~48h疼痛消失,疗效持续48~72h。
用法用量:
研究显示,高剂量(4.8~6.0mg/d)和低剂量(1.5~1.8mg/d)在有效性方面差异无统计学意义,但在安全性方面,低剂量不良反应发生率更低。
因此指南推荐在痛风急性发作期时,秋水仙碱首剂1mg,1h后追加0.5mg,12h后改为0.5mg qd或bid,连续用药至痛风急性症状完全缓解。
我们可再看看秋水仙碱说明书:

值得注意的是:有临床医师交代痛风患者“秋水仙碱每1~2h服用0.5~1mg(1~2片)”,实际上他错过了说明书上很重要的一句话“24h内不宜超过6mg(12片)”。如若患者按医嘱服药,则很可能超剂量用药,导致出现秋水仙碱中毒。
秋水仙碱是细胞有丝分裂毒素,毒性大,治疗剂量与中毒剂量接近,超剂量摄入即可引起严重毒性反应,导致人体多脏器功能损害,死亡率较高。
若患者为老年人,或患者存在肾功能、排泄功能下降,则更容易造成蓄积中毒。秋水仙碱又经肝肠循环解毒,肝功能不全时解毒能力下降,亦使毒性进一步加重。
胃肠道反应是秋水仙碱严重中毒的前驱症状,多发生在用药后2h内;用药后24~72h内,则易出现多器官功能衰竭;用药1周后,幸存患者多器官损伤开始恢复。秋水仙碱中毒目前尚无特效解毒药及有效治疗方法,仅限于保守治疗。
不良反应
« 肾损害:
秋水仙碱有引起急性肾损伤的报道,其经胆汁和肾脏(10%~20%)排泄,肝病患者经肾脏排泄增加,重度肾功能减退时半衰期延长2~3倍。秋水仙碱不能通过透析清除,可增加患者肌肉~神经毒性。
因此,秋水仙碱使用期间需定期监测肾功能变化,且根据肾小球滤过率(GFR)调整剂量。
目前,各指南对肾功能不全患者秋水仙碱剂量调整方案意见不一,如:
《痛风基层合理用药指南(2021)》推荐肾功能不全者酌情减量或延长给药间隔,GFR<10ml/min/1.73m2或透析患者禁用;
《中国肾脏疾病高尿酸血症诊治的实践指南(2017版)》推荐对于慢性肾脏病(CKD)非透析患者GFR≥10ml/min/1.73m2时无需减量,GFR<10ml/min/1.73m2减量50%,血液透析和腹膜透析患者,推荐剂量为肾功能正常患者的50%。
« 消化道损害:
腹痛、腹泻、呕吐及食欲不振为常见的早期不良反应,发生率可达80%,严重者可导致脱水或电解质紊乱。长期服用者可出现严重的出血性胃肠炎或吸收不良综合征。
« 其他不良反应:
骨髓抑制、肌肉和周围神经病变(多见于因预防痛风而长期服用者和轻度肾功能不全者)、脱发等。该药可抑制细胞的正常分裂,对胎儿有致畸作用,因此禁用于妊娠及哺乳期妇女,且女性在服药及停药以后数周内不能怀孕。骨髓增生低下及肾功能不全者,胃肠道疾患者慎用。
02
NSAIDs
作用机制:抑制COX活性,减少前列腺素合成,从而达到抗炎镇痛作用。
临床应用
NSAIDs也是痛风急性发作期一线用药,建议早期足量服用。首选起效快、胃肠道不良反应少的药物。对于有消化道出血风险,建议优先选择COX-2抑制剂。
研究显示,COX-2抑制剂(依托考昔)治疗2~5d时疼痛缓解程度与非选择性COX-2抑制剂(吲哚美辛和双氯芬酸)相当,但胃肠道不良反应和头晕的发生率明显更低。
对于长期服用小剂量阿司匹林的痛风患者,建议优先考虑COX-2抑制剂(塞来昔布)与阿司匹林联用。对于NSAIDs的选择应基于患者的个体化因素。
在预防痛风患者降尿酸初期痛风发作时,对于不能耐受秋水仙碱患者,可选择小剂量NSAIDs(不超过常规剂量的50%),至少维持3~6个月,如小剂量NSAIDs萘普生250mg bid、吲哚美辛50mg bid可明显降低痛风发作频率。基于最新的有效性、安全性等证据,指南推荐NASIDs中首选COX-2抑制剂预防痛风发作。
用法用量:
常用NSAIDs用法用量见表1。
表1 常用NSAIDs用法用量表
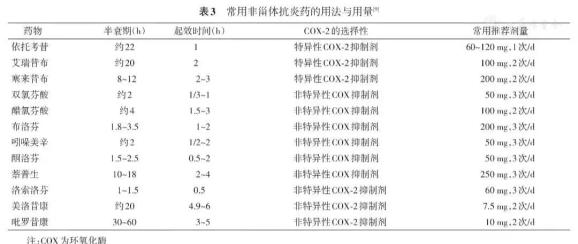
不良反应
« 肾损害:
所有NSAIDs均可能导致肾脏缺血,诱发或加重急慢性肾功能不全。因此,《中国肾脏疾病高尿酸血症诊治的实践指南(2017版)》中不推荐首选NSAIDs治疗CKD非透析患者急性痛风发作,因其也可能增加CKD患者心血管疾病风险。
目前,推荐对于GFR<60ml/min/1.73m2的急性痛风患者,避免长期或大剂量使用,GFR<30ml/min/1.73m2时则禁用。
« 消化道损害:
常见上腹痛、厌食、恶心、呕吐等,偶见上消化道溃疡或出血等。根据临床统计资料,长期服用NSAIDs的患者中约有25%会出现消化道溃疡。
因此,对于存在胃肠道损害高危因素的患者,可选用选择性COX-2抑制剂或者使用非选择性COX抑制剂联合米索前列醇或质子泵抑制剂进行防治。
« 心血管风险:
无论选用哪一类NSAIDs药物(不包括小剂量阿司匹林)都可能提高患者的心血管不良反应风险。美国食品和药物管理局于2015年对NSAIDs药物心血管风险进行评估后,对所有处方类NSAIDs提出了在说明书中加入有关心血管风险提示的要求。
荼普生是引发心血管不良反应风险最低的NSAIDs,布洛芬≤1200mg/d和塞来昔布≤200mg相对较低,而吲哚美辛、双氯芬酸等心血管风险则较高。
对于需长期服用小剂量阿司匹林的患者,可选择心血管风险低但会与阿司匹林产生相互作用的药物,如荼普生。若选用荼普生,患者应在口服阿司匹林后间隔2小时再使用荼普生。
还可选择心血管风险较低且与阿司匹林之间相互作用小的NSAIDs,例如塞来昔布,从国内药物供应实际情况等考虑,使用塞来昔布是最佳方案。
国内有文献对NSAIDs药物的胃肠道和心血管风险等级进行了汇总,见表2。
表2 NSAIDs药物的胃肠道和心血管风险等级及与抗凝药的相互作用

参考文献:
[1]《痛风基层合理用药指南(2021年)》.
[2]《中国肾脏疾病高尿酸血症诊治的实践指南(2017版)》.
[3]《中国高尿酸血症与痛风诊疗指南(2019)》.
[4]《痛风诊疗规范(2020年)》.
[5]张伊莉等.急性秋水仙碱中毒 3 例报告[J].中国职业医学,2019 ,46 (2):203~207.
[6]苏甦,李晓玲.长期口服非甾体抗炎药患者的胃肠道和心血管不良反应防治策略[J].临床药物治疗杂志,2017,15(2):7~11.
[7]杨艳.长期口服非甾体抗炎药患者的胃肠道和心血管不良反应防治策略研究[J].临床医药文献杂志,2019,6(18):197.
[8]Lanas A, Benito P, Alonso J, et al. Safe prescription recommendations for non steroidal anti~inflammatory drugs: consensus document ellaborated by nominated experts of three scientific associations (SER~SEC~AEG)[J]. Reumatol Clin, 2014, 10(2): 68~84.




